
| |
|
| | エリスロポエチン遺伝子の発現制御 |
| |
| 多くの生物ではエネルギー通貨であるATPの供給をミトコンドリアによる酸化的リン酸化に依存しています。組織の酸素分圧の低下があると、種々の遺伝子の発現を変化させ生体を防護します。赤血球は血液中にあって組織への酸素を供給する細胞であり、貧血、出血による失血、血流の停止などがあると、組織は低酸素に陥ります。また、標高の高い地域では気圧の低下に伴う酸素分圧の低下が高山病の原因となります。運動選手の高地トレーニングなどは高地での低酸素応答を利用したものです。このような低酸素応答的反応の中には、個々の組織を構成する細胞の応答の他に、赤血球量の増加もあげられます。 |
|
 |
[図1]研究者自身のREP細胞にもEpo発現刺激を与えるために、年に1度は高地へ赴く。
エリスロポエチン(Epo)は赤血球産生を制御する造血ホルモンであり、組織の低酸素に応答して産生され、骨髄などの造血細胞に働いて赤血球産生を刺激します(図2)。高地トレーニングをしている運動選手の血液では赤血球数、および、酸素運搬に関わるヘモグロビン量が増加しますが、これも低酸素環境におけるEpo産生の亢進によるものです。また、ヒトの大人ではEpoは主に腎臓において産生されます。そのため、人工透析が必要な腎不全患者ではEpoの産生が低下し、貧血となります(腎性貧血)。なお、胎児期後期にはEpoは肝細胞において産生されており、出生後も肝細胞に少量のEpo産生能が認められます。 |
|
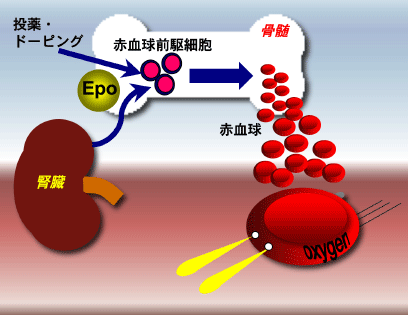 |
[図2]体内で低酸素状態が感知されると、腎臓でのEpo産生と分泌が誘導される。その結果、Epoは骨髄中の赤血球前 駆細胞に分化・増殖を促すため、体内の赤血球数が亢進し、酸素供給能が高くなる。赤血球は肺で得た酸素を全身に配る運び屋である。一方、Epo製剤の開発 により、貧血治療やドーピングでは、 Epoの注射によって赤血球数を増加させることもできるようになった。
私たちはこのようなEpo遺伝子の転写制御について、主に個体レベルの研究を行ってきました。遺伝子の転写反応は、個体発生や細胞分化に伴いプログラムにしたがって遺伝子の発現が制御される「組織特異的制御」と、生体周囲の環境変化に応じて変化する「誘導的制御」の2大要素によって制御されています。Epo遺伝子は腎臓など組織に特異的に発現する「組織特異的制御」と低酸素による「誘導的制御」の両者が必要な非常に優れたモデル遺伝子です。 |
|
Epoは骨髄などにおいて赤血球前駆細胞上に存在するEpo受容体と結合して細胞内にシグナルを伝達し、非常に高い赤血球産生促進作用を有しています。実際に、Epoは世界初の遺伝子組換え製剤として、貧血、特に、腎性貧血の治療に効果を発揮し、分子生物学研究が医療に応用された金字塔となっています。その一方で、一部のスポーツ選手が、Epoを使って赤血球数を増加させて酸素運搬能力=持久力を向上させようとするドーピング利用も出現しました。赤血球が増えすぎると血栓をつくりやすくなり、心筋梗塞や脳梗塞などの危険性が増すため、Epoは世界アンチドーピング機構(WADA)の禁止薬物にも指定されています。
近年では、Epoの受容体は血液系の細胞のみならず、神経や心筋細胞など様々な細胞に発現していることが明らかになりました。梗塞等血流の遮断や低酸素、圧負荷などのストレス下で細胞を保護する作用があり(1,2)、実際に、組織保護作用を期待してEpoを投与する試みも行われています。一方で、Epoの遺伝子組換え製剤は腎性貧血の治療に大変有効ですが、頻回に注射が必要である、不応例がある、などの問題もあり、使いやすく副作用の少ない新規製剤の開発も行われています。
|
|
| 遺伝子発現制御機構の解析を勧めるには、まず、その遺伝子の発現様式を知る必要があります。古くからEpoの産生が腎臓で起きていることは報告されていました。また、腎不全によってEpo依存性の貧血になることもEpoが腎臓で産生されていることを示しています。しかし、腎臓を構成する種々の細胞の中で、どの細胞がEpo産生に関わっているのかについては、様々な説があり、確定的な報告はありませんでした。そこで、私たちはレポータートランスジェニックマウス法による腎臓のEpo産生細胞の同定を計画しました。 |
|
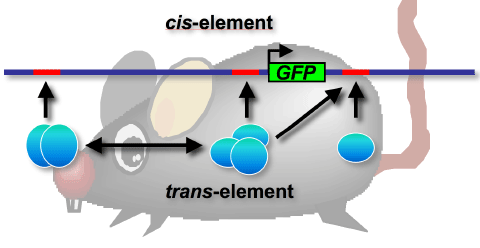 |
[図3]BAC-GFPトランスジーンを用いたEpo遺伝子発現制御機構の解析。Epo遺伝子発現は、 Epo遺伝子近傍のcis-element(DNA)とtrans-element(タンパク質)との複雑な相互作用により、組織特異的および低酸素誘導的に調節されていると考えられる。本研究では、約200 kbにおよぶ巨大DNAとGFP遺伝子を利用し、Epo遺伝子のcis-element同定に挑んでいる。トランスジーンがEpo遺伝子の重要なcis- elementを含んでいた場合、トランスジェニックマウスはGFPを発現し、緑色蛍光が観察される。
これまでの研究により、個体で機能するEpo遺伝子発現制御には20 kbp以上の広い領域が必要であることが分っておりましたので、Epo遺伝子を含む約180 kbpの大腸菌人工染色体(BAC: Bacterial Artificial Chromosome)にEpo遺伝子部分に緑色蛍光蛋白質(GFP: Green Fluorescent Protein)遺伝子を組み込み、これをマウスに導入したトランスジェニックマウスを作製しました(3,4)。このマウスでは、胎児期の肝細胞においてGFPの発現がみとめられました。成体においては、瀉血や薬剤による溶血により貧血を誘導すると腎臓においてGFPの蛍光が観察されました(図4ムービー)。このGFP発現細胞の数は貧血が高度になると血中Epo濃度の上昇と一致して増加しました。わたくしたちは、この細胞をREP (Renal Epo Producing) 細胞と考え、腎臓内にはEpo産生能を有する細胞が存在し、それぞれの低酸素(貧血)の閾値にしたがってEpo遺伝子発現のオンーオフを決めていると考えました。また、この結果から、導入したレポーター遺伝子には腎臓、肝臓の組織特異的発現制御、および、低酸素による誘導的発現制御に必要な制御領域が含まれていることが分りました。
これらREP細胞は皮質と髄質の境界部の近位尿細管周囲の間質にあり、細長い突起を伸ばした線維芽細胞様、あるいは神経細胞様の形態を持ち、尿細管と血管内非細胞に接着して存在します。また、REP細胞同士も近接しており、細胞間のコミュニケーションの存在も示唆されました。現在、免疫染色、GFPの蛍光を利用したREP細胞の分離などが進行中であり、REP細胞の性質の解析の中から、低酸素誘導的な制御機構の解明が進むことが期待されます。
|
|
私たちは、遺伝子領域の解析から、EPO発現の組織特異性と低酸素誘導性を制御するメカニズムの研究を進めております。Epo遺伝子は低酸素誘導的な発現制御を行う代表的な遺伝子として研究が進められ、3’側に接して存在する領域に低酸素応答性の配列には低酸素応答に重要な転写因子であるHIF(Hypoxia-inducible factor)-1αが同定されました。HIFにはHIF-2α(5)、HIF-3αがあり、いずれもbHLH-PASと呼ばれる構造を持ち、Arnt/HIFβと呼ばれる共通の因子とダイマーを形成してほぼ共通のDNA配列を認識して結合します。HIFによる低酸素応答性の遺伝子発現誘導には酸素分圧応答性のプロリン水酸化酵素(PHD: proline hydroxylase)による水酸化とVHL(Von Hippel-Lindau Tumor Suppressor Protein)を介したユビキチン化、プロテアソームによる分解が関わることが明らかになっています。PHDにもPHD1、PHD2、PHD3の3種類のアイソザイムが存在し、低酸素誘導性やその機能に差がある事が知られています。 HIFによる低酸素応答性の制御は他の様々な遺伝子においても明らかになり、また、細胞のがん化などにも関わることが示されており、今後の研究が期待される分野です。
HIFのアイソフォームのうち、低酸素刺激によるEpo遺伝子の制御には、いろいろな報告からHIF-2αが関わっていることが示唆されています。私たちはトランスジェニックマウスレポーター法などによる遺伝子領域の検討(シス領域の検討)を行いながら、EPO産生細胞における組織特異的、低酸素誘導的なEPO産生制御機構の解明を目指して研究を進めております。また、PHD1、PHD2、PHD3やHIF-2αそれぞれの遺伝子破壊マウスを用いた解析等を通し、EPO産生細胞における転写因子HIFの制御についても研究を進めております(11,14)。これまでにREP細胞におけるEpo遺伝子の制御ではPHD2を介したHIF-2αによる制御が重要である事を示しました(11)。
私たちは、HIFによるEpo遺伝子の正の制御だけでなく、他の転写因子による負の制御の可能性にも注目して解析を行っております。これまでに、Epo遺伝子のプロモーターにはGATA因子の結合配列があり、この配列へのGATA因子の結合がEpo遺伝子発現を抑制している可能性について検討を行って参りました(6)。最近、私たちはBACを用いたレポータートランスジェニックマウスの系において、このGATA配列に変異を導入すると、腎臓の遠位尿細管や集合管などにおいて遺伝子の異所性発現が恒常的に認められることを報告しました(3)。腎臓ではGATA2, GATA3などのGATA因子が発現しており、これらのEpo遺伝子への結合が異所性発現を抑えているものと考えられました。
|
|
| Epo-Epo受容体の遺伝子改変によるモデル動物系 |
| Epo欠損マウス、Epo受容体欠損マウスは胎生期に貧血となり死亡してしまいます。私たちは、赤血球特異的な転写活性を持つGata1遺伝子領域を用いてEpo受容体を発現するトランスジェニックマウスを作製し、これをEpo受容体欠損マウスと交配することにより、赤血球系細胞においてのみEpo受容体を発現するマウス(EpoR-レスキューマウス)を作製しました(参考文献7)。このマウスでは胎生期の貧血は回避されて正常に出生し、出生後もとくに問題は認められませんでした(図5)。この結果は、Epoの赤血球以外の細胞における効果は、通常の飼育環境におけるマウスの発生や生存、繁殖には必須ではないことを示しています。このマウスを使った共同研究により、Epoの神経系、心血管系などにおける作用について新しい知見が得られています(1,2,5)。 |
|
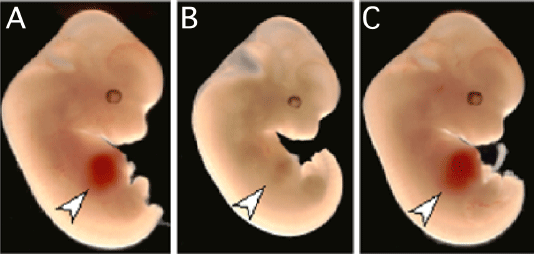 |
[図5]Epo受容体欠損マウスの胎児(B)は、貧血であり、肝臓(矢印)が白く見える。Epo受容体欠損マウスは生まれることができないが、このマウスの赤血球系細胞でのみEpo受容体を発現させると、貧血が改善され、正常に発育した(C)。(A)は正常マウスの胎児。
*当マウスは理研BRCより分与可能です。ご興味のある方は山本雅之教授までご連絡ください。
リンク
|
|
| 私たちはまた、中外製薬との共同研究によりEpo欠損マウスのトランスジェニックレスキュー系を開発しました(山㟢ASH)。この系を用いて、今までGFPの蛍光によって検討されていたEpoの発現制御についてEpo自身の発現量の変化として捉えることが可能になり、GFPレポータートランスジェニックマウス作製に用いられたBAC領域によるオンとオフの両方の制御が働き、Epo産生の制御が過不足なく産生されていることが遺伝子発現制御の検討に威力を発揮することが期待されています。さらに、Epo遺伝子の変異体などの研究にも応用できる可能性があります。 |
|
| EPOは、赤血球造血に必須のホルモンですが、赤血球造血は発生の過程でも起きており、Epo遺伝子欠損マウスは胎生13日頃に造血障害により致死となります。赤血球造血は、発生過程において、胎生7.5日から卵黄嚢の血島で行われる一次造血と、それに引き続きAorta-Gonad-Mesonephros領域、胎児肝臓、脾臓、骨髄で行われる二次造血があります。Epo遺伝子欠損マウスの詳細な解析の結果、Epo遺伝子欠損により二次造血だけでなく一次造血細胞においても、細胞数の減少、赤血球マーカーの発現低下などの障害が認められており、Epoは二次造血だけでなく、正常な一次造血にも必須であることが示されました。一方で、これまで胎仔期のEPO産生臓器は胎児肝臓が知られておりましたが、胎児肝臓におけるEPO産生は胎生9.5日以降に行われるため、一次造血に寄与するEPOの由来は不明でありました。そこで私たちは、前述したEPO産生をGFPにより観察することが可能なマウスを用い、胎仔期EPO産生細胞を解析しました。その結果、胎生8.5日頃から胎児頭部の組織においてGFP蛍光が観察され、GFP蛍光を指標に分取したこれらの細胞で、実際にEPOが産生されていることを確認し、これらの細胞をNeural Epo-Producing(NEP)細胞と名付けました。より詳細な解析の結果、NEP細胞は神経上皮細胞の一部と、神経堤細胞の一部からなる細胞群であり、NEP細胞からのEPOが一次造血を支えていることが明らかとなりました(図6)(8)。 |
|
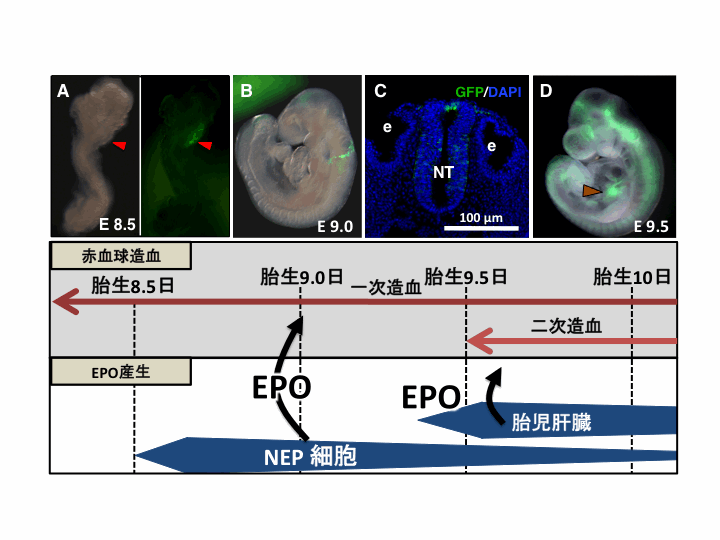 |
| [図6]胎生8.5日胚(A)の頭部でGFP蛍光(EPO産生)が認められる(赤矢頭)。胎生9.0日胚(B)の凍結切片を観察すると、神経上皮細胞などでGFP蛍光が認められる(C)。胎生9.5日胚になると、胎児肝臓(茶矢頭)においてGFP蛍光が認められる様になる。e;耳胞 NT;神経管 |
|
| 前述した通り、遺伝子組換え製剤としてリコンビナントEPOは慢性腎臓病などに伴う腎性貧血に対する有効な薬剤として広く用いられております。ではなぜ慢性腎臓病で腎性貧血が引き起こされるのでしょうか?近年、私たちはEPO産生細胞をGFP蛍光などのレポータータンパク質をモニターする事が可能な遺伝子改変マウスとEPO欠乏性の慢性貧血マウスを樹立し、様々な腎臓障害モデルと組み合わせる事で、この問題の解決に取り組んできました(9, 10)。慢性腎臓病では、腎臓皮質領域の線維芽細胞が筋線維芽細胞へと変化し細胞外基質の過剰産生を伴う線維化という病態があります。「腎臓におけるEPO産生細胞の同定」の項で記載した通り、REP細胞は線維芽細胞の特徴を持った細胞でありますが、慢性貧血による長期低酸素ストレス下にしたモデルマウスの解析から腎臓皮質領域の広範な領域の線維芽細胞がREP細胞としての機能を持っている事が明らかとなっています(9, 13)。腎障害モデルを用いた解析から、腎障害時にはこれらのREP細胞がEpo遺伝子の発現を止め、筋線維芽細胞へと変化してしまう事が明らかとなりました(10, 11, 12)。また線維化は不可逆的な変化と考えられておりますが、このREP細胞から筋線維芽細胞への変化は腎障害の初期であれば、障害を除去する事でEPO産生能が回復することも確認されております。今後、REP細胞の筋線維芽細胞への変化する機序をさらに詳細に明らかにする事で、腎性貧血の抑制へと繋がると考えております(図7)。 |
|
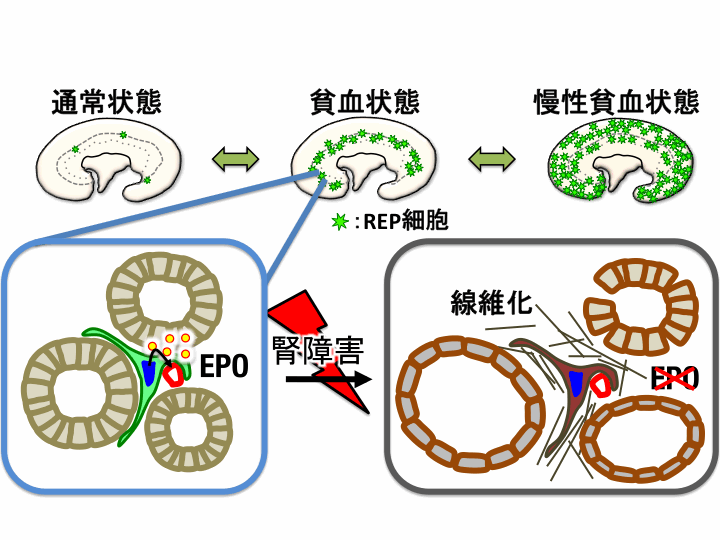 |
| [図7] 通常REP細胞は腎臓髄質皮質境界部でのみ見つかるが、慢性貧血による長期の低酸素ストレス下では皮質領域の広範な領域で認められる。腎障害時はREP細胞がEPO産生能を失い、筋線維芽細胞へと形質転換してしまい線維化が生じる。 |
|
1. Satoh K, Kagaya Y, Nakano M, et al. Important Role of Endogenous Erythropoietin System in Recruitment of Endothelial Progenitor Cells in Hypoxia-Induced Pulmonary Hypertension in Mice. Circulation. 2006;113:1442-1450.
2. Asaumi Y, Kagaya Y, Takeda M, et al. Protective Role of Endogenous Erythropoietin System in Nonhematopoietic Cells Against Pressure Overload-Induced Left Ventricular Dysfunction in Mice. Circulation. 2007;115:2022-2032.
3. Obara N, Suzuki N, Kim K, Nagasawa T, Imagawa S, Yamamoto M. Repression via the GATA box is essential for tissue-specific erythropoietin gene expression. Blood. 2008;111:5223-5232.
4. Suzuki N, Obara N, Yamamoto M, Helmut S, Bernhard Bn. Use of Gene-Manipulated Mice in the Study of Erythropoietin Gene Expression. Methods in Enzymology. Vol. Volume 435: Academic Press; 2007:157-177.
5. Morita M, Ohneda O, Yamashita T, et al. HLF/HIF-2alpha is a key factor in retinopathy of prematurity in association with erythropoietin. EMBO Journal. 2003;22:1134-1146.
6. Nakano Y, Imagawa S, Matsumoto K, et al. Oral administration of K-11706 inhibits GATA binding activity, enhances hypoxia-inducible factor 1 binding activity, and restores indicators in an in vivo mouse model of anemia of chronic disease. Blood. 2004;104:4300-4307.
7. Suzuki N, Ohneda O, Takahashi S, et al. Erythroid-specific expression of the erythropoietin receptor rescued its null mutant mice from lethality. Blood. 2002;100:2279-2288.
8. Suzuki N, Hirano I, Pan X, et al. Erythropoietin production in neuroepithelial and neural crest cells during primitive erythropoiesis. Nature Communications. 2013; 4; 2902. ncomms3902.
9. Yamazaki S, Souma T, Hirano I, et al, A mouse model of adult-onset anaemia due to erythropoietin deficiency. Nat Commun. 2013; 4; 1956. Ncomms2950.
10. Souma T, Yamazaki S, Moriguchi T, et al. Plasticity of renal erythropoietin-producing cells governs fibrosis. J Am Soc Nephrol. 2013; 24; 1599-616.
11. Souma T, Nezu M, Nakano D, et al, Erythropoietin synthesis in renal myofibroblasts is restored by activation of hypoxia signaling. J Am Soc Nephrol. 2015
12. Souma T, Suzuki N, Yamamoto M. Renal erythropoietin-producing cells in health and desease. Front Physiol. 2015; 6; 167.
13. Suzuki N, Yamamoto M. Role of renal erythropoietin-producing(REP) cells in the maintenance of systematic oxygen homeostasis. Pflugers Arch. 2015
14. Tojo Y, Sekine H, Hirano I, et al. Hypoxia signaling cascade for erythropoietin producing in hepatocytes. Mol Cell Biol. 2015; 35; 2658-72.
|
CGI-design
|






