
| |
| Nrf2活性化によるアルツハイマー病改善効果 |
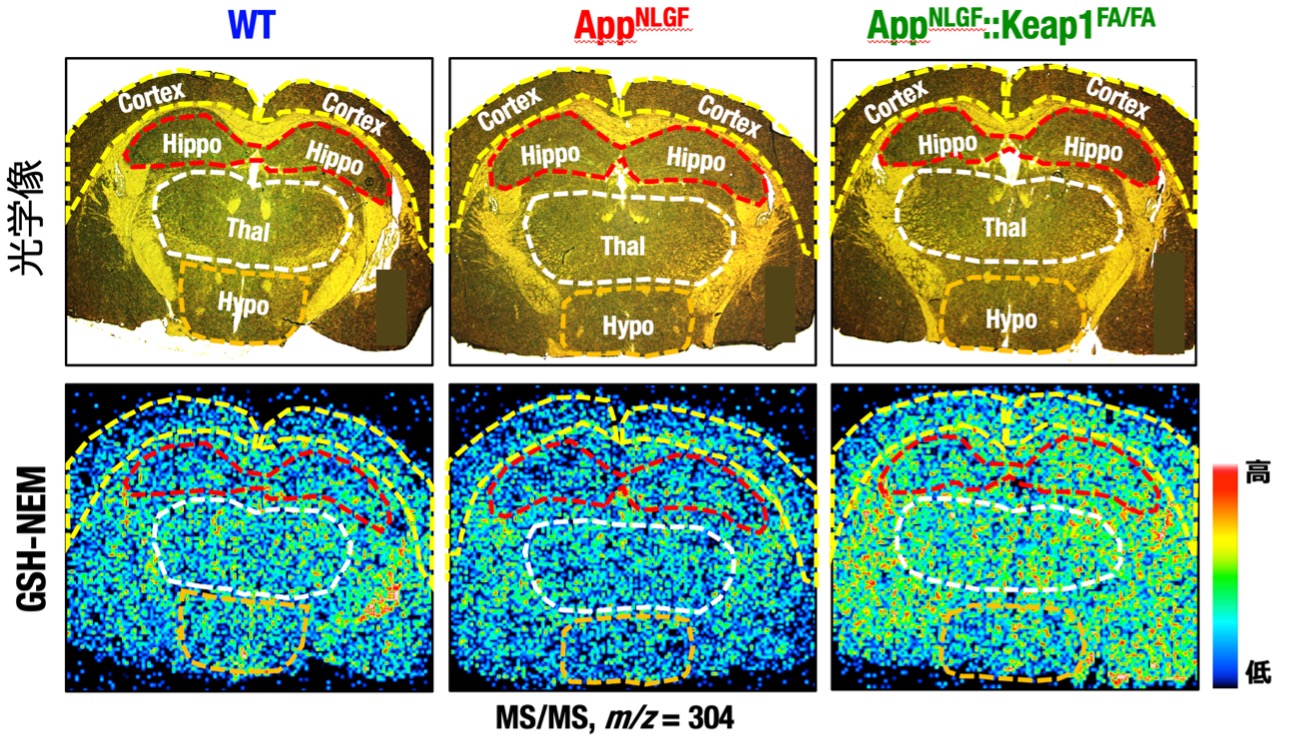
| 高齢化に伴い認知症の患者数は年々増加しています。アルツハイマー病は認知症の最大の原因とされていますが、根本的な治療法の開発が待たれています。アルツハイマー病は、アミロイドβが異常蓄積し酸化ストレスや神経炎症などが引き起こされ、認知機能障害が発症すると考えられています。転写因子Nrf2の活性化は、酸化ストレスや炎症を軽減することが知られていることから、アルツハイマー病におけるNrf2活性化の役割を検討しています。 遺伝子変異によるアミロイドβが異常蓄積するアルツハイマー病モデルマウス(理化学研究所西道隆臣博士提供、AppNLGFマウス)に対して、Keap1遺伝子変異を導入して(Keap1FA/FAマウス)、Nrf2活性化アルツハイマー病モデルマウスを作出し(AppNLGF::Keap1FA/FAマウス)、解析を行いました。 Nrf2は、抗酸化分子であるグルタチオンの合成のための酵素の遺伝子発現を増加させて、細胞内のグルタチオンを増加させることが知られています。このため、組織切片上で代謝物分布を評価する解析方法である質量分析イメージングを用いて、還元型グルタチオン(GSH)の解析を行いました。還元型グルタチオンは反応性が高く、組織内での正確な解析が困難なため、システインと反応するN-エチルマレイミド(NEM)という化合物を脳組織切片に添加し、誘導体化されたGSH-NEM分子を測定することで、安定したGSH測定を可能としました。その結果、アルツハイマー病モデルAppNLGFマウスの脳では、野生型(WT)マウスと比較して軽度のGSH低下を認めました。一方、Nrf2活性化アルツハイマー病モデルAppNLGF::Keap1FA/FAマウスの脳では、AppNLGFマウスと比較してGSHの増加を認めました。 |
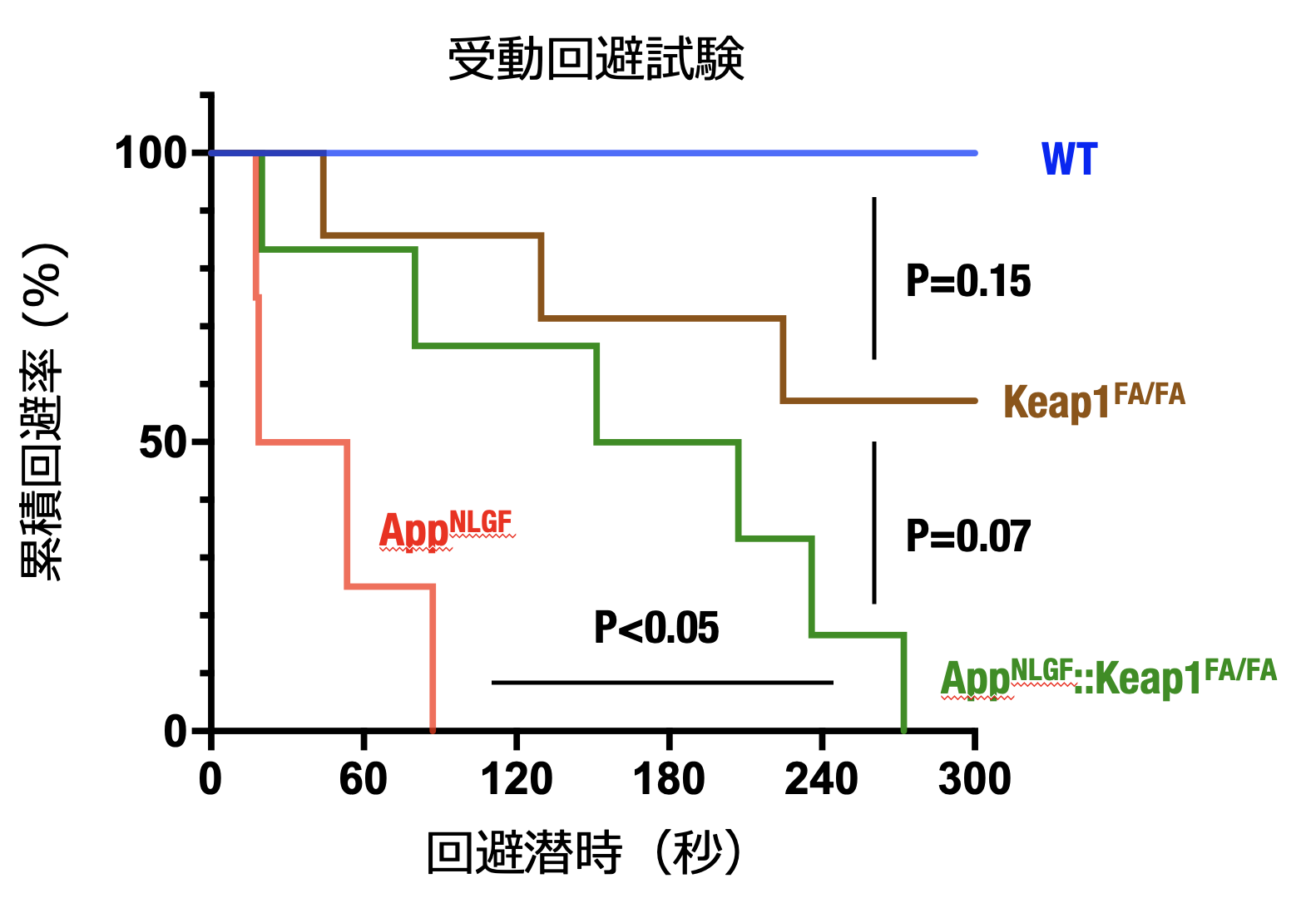
| さらに、アルツハイマー病の症状の一つである認知機能障害におけるNrf2活性化の効果を調べるために、行動解析の一つである受動回避試験を行いました。その結果、アルツハイマー病モデルAppNLGFマウスでは野生型(WT)マウスと比較して、認知機能障害で現れる所見である、回避潜時の短縮を認めました。ところが、Nrf2活性化アルツハイマー病モデルAppNLGF::Keap1FA/FAマウスでは、AppNLGFマウスと比較して回避潜時が延長していたことから、遺伝子改変によるNrf2活性化は、アルツハイマー病の病態である認知機能障害を改善していることが明らかとなりました。 |
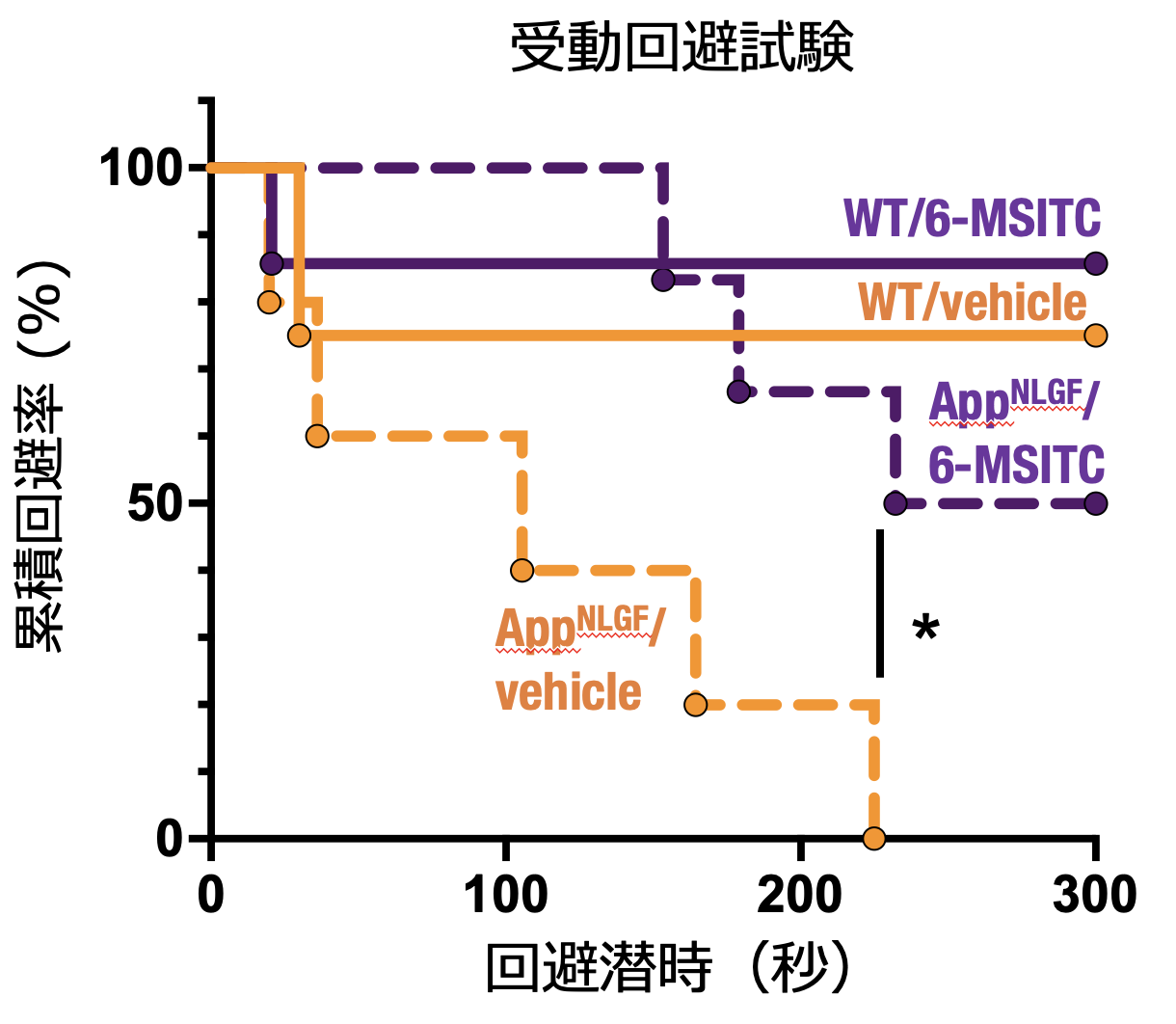
| さらに、Nrf2を活性化する天然化合物である6-メチルスルフィニルヘキシルイソチオシアネート(6-MSITC)を飲水中に混合して、マウスに投与し、その効果を評価しました。認知機能障害を調べるための受動回避試験では、対照群として6-MSITCを含まない水を飲水させたアルツハイマー病モデルマウス(AppNLGF/vehicle)では、同じく6-MSITCを含まない水を飲水させた野生型マウス(WT/vehicle)と比較し、回避潜時の短縮を認めました。一方で、6-MSITCを含む水を飲水させたアルツハイマー病モデルマウス(AppNLGF/6-MSITC)では対照群のAppNLGF/vehicleと比較して、回避潜時が延長していたことから、化合物によるNrf2活性化も、アルツハイマー病モデルマウスにおける認知機能障害を軽減することを解き明かすことができました。 |
| 以上から、アルツハイマー病モデルマウスにおけるKeap1遺伝子改変によるNrf2活性化が、抗酸化分子であるグルタチオンを増加させ、認知機能障害を軽減したことから、Nrf2活性化がアルツハイマー病の病態を改善することを証明できました。さらに、化合物の投与によるNrf2活性化も同様にアルツハイマー病の認知機能障害を軽減したことから、Nrf2はアルツハイマー病の治療標的分子として有用であることが示されました。 参考文献 1. Uruno A, Matsumaru D, Ryoke R, Saito R, Kadoguchi S, Saigusa D, Saito T, Saido TC, Kawashima R, Yamamoto M. Nrf2 Suppresses Oxidative Stress and Inflammation in App Knock-In Alzheimer's Disease Model Mice. Mol Cell Biol 40, e00467-19 (2020). |
| プロジェクト一覧へ戻る | [編集] |